国家药监局公布重磅消息,关系所有药企,通过一致性评价对药企来说至关重要

▍最新相关消息
据国家药监局官网消息,为指导化学药品注射剂的研发,在国家药品监督管理局的部署下,药审中心组织制定了《化学药品注射剂包装系统密封性研究技术指南(试行)》和《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)》。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审核同意,现予发布,自发布之日起施行。
国家药监局官网发布2020年10月21日内容之前,2020年5月14号国家药监局发布《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》。
▍政策解读
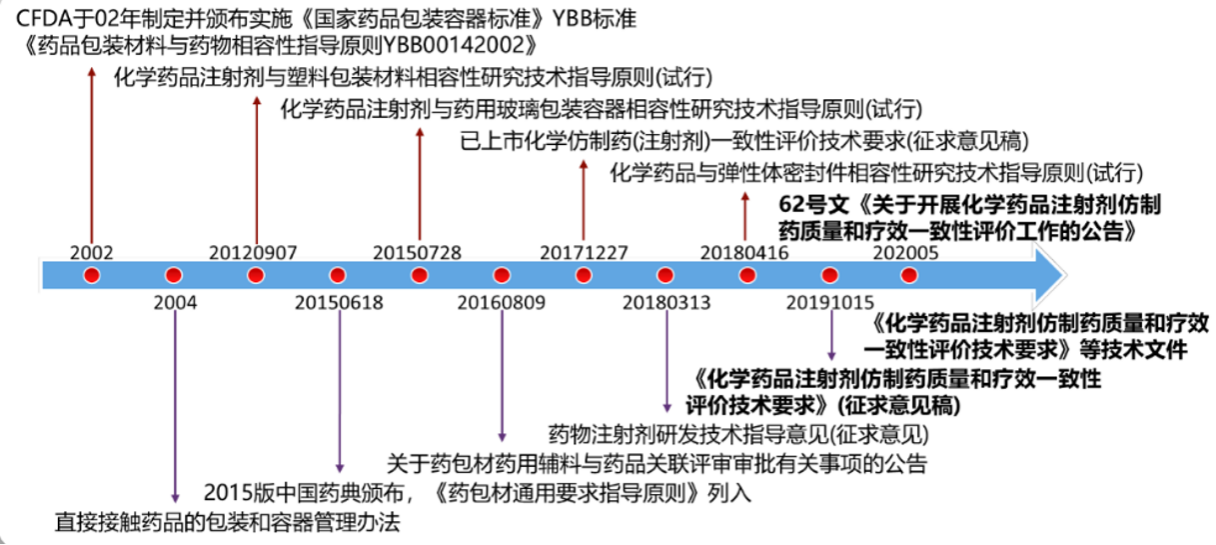
《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》政策解读
一、《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》出台的背景是什么?
答:为贯彻落实国务院关于加快推进仿制药一致性评价的工作部署,国家药监局仿制药一致性评价办公室组织专家委员会制定了《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》等系列文件,经广泛征求社会意见并修改完善后予以发布,正式启动了化学药品注射剂仿制药质量和疗效一致性评价工作。
二、化学药品注射剂仿制药一致性评价的对象包括哪些?
答:已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。
尚未收载入《仿制药参比制剂目录》的品种,药品上市许可持有人应当按照《国家药监局关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)规定申报参比制剂,待参比制剂确定后开展一致性评价研发申报,避免出现因参比制剂选择与国家公布的参比制剂不符,影响研究项目开展、造成资源浪费等问题。
对临床价值明确但无法确定参比制剂的化学药品注射剂仿制药,如氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水等,此类品种无需开展一致性评价。国家药监局仿制药一致性评价办公室将组织专家委员会进行梳理,分期分批发布此类品种目录,鼓励药品上市许可持有人按照《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》等相关指导原则开展药品质量提升相关研究,并按照药品上市后变更管理有关规定申报,执行一致性评价的审评时限。
三、化学药品注射剂仿制药一致性评价的时间要求是什么?
答:依据《国家药品监督管理局关于仿制药质量和疗效一致性评价有关事项的公告(2018年第102号)》等有关规定执行。
四、化学药品注射剂仿制药一致性评价审评时限要求是什么?
依据《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号),审评工作应当在受理后120日内完成。经审评认为需申请人补充资料的,申请人应在4个月内一次性完成补充资料。发补时限不计入审评时限。
五、通过一致性评价的品种,是否继续享受相关政策支持?
答:通过一致性评价的品种,药品监管部门允许其在说明书和标签上予以标注,并将其纳入《新批准上市以及通过仿制药质量和疗效一致性评价的化学药品目录集》。相关部门也将按照《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)的要求给予政策支持。
▍药企迎挑战
通告自发布之日起施行,意味着中国药品检测技术要求更加标准化。
实现药品检测标准技术要求的协调、一致,对开展政策的制药企业而言,有利于进入市场,也有利于中国生产的药品走向国际,推动中国药企发展。
由于我国的制药产业检测标准严格化。所以,中国药企面临的挑战也会更大。
